Interferone - Questione di metodo
INTERFERONE - ASPETTI DI METODO
Prima che un nuovo farmaco venga studiato su un paziente deve venire attentamente valutato in laboratorio (fase pre-clinica) per vedere se ha una attività biologica e se produce effetti tossici.
Le prime fasi di una ricerca non possono dirci esattamente come e quanto un nuovo trattamento sarà utile. E’ solo nell’ultima fase dello sviluppo e messa a punto attraverso gli studi clinici che si farà un confronto tra la cura e un altro trattamento (o placebo, vedi Gruppo di controllo).
I presupposti etico- scientifici di uno studio sono i seguenti:
• il miglior trattamento disponibile non è soddisfacente
• deve esistere una ragionevole aspettativa che il nuovo trattamento funzioni meglio del vecchio
• deve esserci ancora incertezza su quale sia la cura migliore
A seconda di quando viene disegnato lo studio rispetto a quando si è verificata la condizione che viene indagata, gli studi possono essere prospettici o retrospettivi.
Gli studi prospettici valutano gli effetti di un intervento seguendo le persone coinvolte a partire dall’inizio dello studio e fino alla sua conclusione, per osservare gli esiti dell’intervento stesso.
Gli studi retrospettivi misurano eventi accaduti in un periodo precedente rispetto al disegno dello studio.
Uno studio retrospettivo è solitamente meno affidabile di uno studio prospettico, perché nello studio prospettico le caratteristiche dei soggetti inclusi, i dati raccolti e gli esiti misurati sono definiti prima dello svolgimento dello studio e sono pianificati; in definitiva, i dati vengono raccolti in modo da ottenere un buon livello di qualità, cosa non garantita dagli studi retrospettivi, in cui i dati a disposizione sono stati raccolti prima che lo studio iniziasse.
Sperimentare vuol dire “perturbare” la natura in contesti controllati introducendo un intervento. Per valutare se il cambiamento osservato sia attribuibile a un intervento determinato (e non al caso, all’errore o ad altro intervento) è necessario condurre studi che prevedano un campione adeguato, un trattamento di confronto e procedimenti per evitare l’azione di fattori che possano influenzare e confondere i risultati.
Si tratta di studi prospettici che possono prevedere o meno la presenza di:
• un gruppo di controllo: i partecipanti allo studio vengono divisi in due o più gruppi. Uno riceve il farmaco in sperimentazione, l’altro un farmaco già in commercio o un placebo con cui viene confrontato il trattamento in sperimentazione.
Perché avere un gruppo di controllo? Per poter confrontare il gruppo che riceve il trattamento in studio con un gruppo che non lo riceve, e serve da controllo. Questo permette di valutare se gli esiti di interesse si possono attribuire al trattamento in studio, e non ad altri fattori, o al caso.
Il controllo può essere:
• il migliore trattamento disponibile al momento dello studio
• un altro trattamento disponibile
• il placebo
• nessun trattamento
Alcuni sostengono che il placebo è un fondamentale termine di riferimento per valutare un trattamento, soprattutto quando manca un chiaro trattamento standard ottimale.
• randomizzazione: i partecipanti vengono divisi nei due gruppi (intervento e controllo) in modo casuale.
Perché randomizzare? La randomizzazione ha lo scopo di rendere simili i gruppi a confronto per le loro caratteristiche. L'effetto del trattamento può essere studiato in gruppi di persone che sono simili all'inizio e trattati allo stesso modo, eccetto che per l'intervento in studio. Quindi qualsiasi differenza vista alla fine tra i gruppi può essere attribuita esclusivamente al trattamento e non a errori sistematici al caso.
• mascheramento (cosiddetto cieco), può essere singolo, doppio, triplo: né il paziente né il medico sperimentatore conoscono a che gruppo è assegnato ciascun singolo paziente (doppio cieco); oppure solo il paziente o solo il medico non sa a che gruppo è stato assegnato il paziente (singolo cieco); infine è possibile che né il medico, né il paziente, né chi elabora i dati conoscano l’assegnazione del paziente al gruppo.
Perché usare il mascheramento? Il paziente potrebbe essere influenzato dal sapere quale trattamento ha ricevuto, anche i medici potrebbero valutare diversamente la condizione del paziente sapendo quale trattamento ha ricevuto.
Gli studi possono essere in aperto, quando paziente, medico e chi analizza i dati conoscono quale farmaco si sta usando e a quale dose.
Il modello di riferimento migliore per studiare un farmaco è lo studio clinico controllato randomizzato. La valutazione dell’efficacia di un farmaco può essere fatta anche utilizzando studi non randomizzati, la cui qualità e risultati sono comunque meno certi di quello che deriva da uno studio randomizzato ben condotto.
Il modello di riferimento per studiare un farmaco è lo studio clinico controllato randomizzato (in inglese Randomized clinical trial, RCT). La semplice osservazione non è sufficiente per documentare il valore di un farmaco: bisogna accumulare una serie di prove che derivano da esperimenti scientifici che permettano di dare un giudizio basato su esperienze ripetibili e verificabili.
Lo studio clinico controllato randomizzato è uno studio di intervento in cui i partecipanti sono assegnati in modo casuale (randomizzato) a ricevere il trattamento sperimentale o il trattamento di controllo.
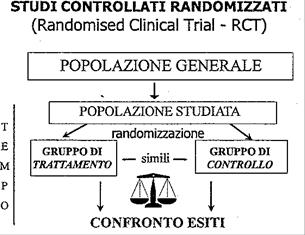
Vantaggi
Quando gli studi clinici controllati e randomizzati sono condotti in modo appropriato, l'effetto del trattamento può essere studiato in gruppi di persone che sono simili all'inizio e trattati allo stesso modo, eccetto che per l'intervento in studio. Quindi qualsiasi differenza vista alla fine tra i gruppi può essere attribuita esclusivamente al trattamento e non a errori sistematici o al caso.
E’ considerato il metodo scientificamente più valido per valutare l’efficacia di un trattamento, per i seguenti motivi:
-è presente un gruppo di confronto
-l’assegnazione casuale dei partecipanti (randomizzazione) a uno dei due gruppi (intervento o confronto) aumenta la probabilità che i due gruppi siano simili in partenza, e che eventuali differenze negli esiti dipendano solo dal tipo di trattamento assegnato
Svantaggi
I pazienti che partecipano a uno studio clinico sono selezionati e quindi i risultati dello studio possono avere limiti di generalizzabilità, cioè la loro applicazione ad altri gruppi di pazienti, non partecipanti allo studio, può avere dei limiti. La durata di questi studi in genere è troppo corta (2-3 anni) e non permette di avere risultati sull’efficacia e sugli eventi avversi del trattamento nel lungo periodo (a medio-lungo termine). Inoltre, il numero di persone coinvolte in questi studi è in genere piccolo, quindi è difficile che eventi rari legati al trattamento possano essere portati alla luce da questi studi. In definitiva, questo tipo di studi quindi non permette di valutare efficacia ed effetti avversi a lungo termine di un trattamento, ed eventuali eventi rari associati al trattamento.
E’ una variazione dello studio randomizzato. Si tratta di un tipo di studio in cui i trattamenti vengono provati sullo stesso paziente uno dopo l'altro, con un ordine che deve essere casuale; in questo modo ogni soggetto funge anche da controllo di sé stesso. Per esempio, i soggetti vengono assegnati in modo casuale al trattamento A o al trattamento B. Successivamente i soggetti trattati con A verranno trattati con B e viceversa. Tra un ciclo di trattamento e l'altro intercorre un periodo di sospensione, detto lavaggio o washout.
Vantaggi
Non necessitano di controlli indipendenti, perché tutti i soggetti ricevono sia il trattamento in esame sia quello di controllo.
Svantaggi
Sono fonte di possibili errori gravi, consentono una generalizzazione limitata.
E’ uno studio non randomizzato, in cui un gruppo definito di persone (la coorte) sono seguite nel tempo. A fine studio si confrontano gli esiti tra le persone del gruppo, per valutare ad esempio se c’è differenza degli esiti tra le persone che sono state trattate con farmaci diversi oppure tra le persone che hanno caratteristiche diverse (ad esempio confronto tra persone giovani ed anziane, oppure tra maschi e femmine). Una coorte può essere costruita nel presente e seguita nel futuro ( “studio prospettico”) oppure la coorte può essere identificata mediante documentazione clinica del passato e seguita dal periodo a cui risale la documentazione fino al presente ( “studio retrospettivo” o di “coorte storica”).
Vantaggi
Si possono studiare gli effetti dei trattamenti a medio e lungo termine. Sono studi più rappresentativi delle persone con la malattia rispetto alle persone che vengono incluse negli studi randomizzati. E’ possibile quindi valutare se il trattamento è efficace anche nelle persone che sono escluse dagli studi randomizzati (ad esempio, quelle che hanno più di un problema di salute, o gli anziani) e studiare gli eventi avversi a medio-lungo termine. Questo tipo di studi permette di valutare benefici o eventi avversi rari.
Svantaggi
In questo tipo di studi il confronto non è fatto tra gruppi assegnati casualmente (randomizzazione) ad un trattamento piuttosto che ad un altro. Di conseguenza il rischio di conclusioni sbagliate è molto alto quando si utilizza questo tipo di studi per valutare l’efficacia di un trattamento. Infatti, spesso, i gruppi a confronto sono diversi per caratteristiche di significato prognostico che da sole possono spiegare i risultati diversi tra i gruppi a confronto, indipendentemente dal trattamento che si voleva valutare.
Un caso clinico singolo è uno studio su una singola esperienza clinica. Uno studio di serie di casi è una descrizione di un certo numero di casi.
Vantaggi
Segnalano l’allarme e sono utili nel caso di eventi rari.
Svantaggi
Sono fonte di possibili distorsioni, non consentono la generalizzazione.
Le regole metodologiche non vengono rispettate: sono inclusi soggetti non adatti allo scopo dello studio, il trattamento viene somministrato male, chi valuta i risultati delle cure non lo fa bene, l’osservazione sui malati è troppo breve, il numero di malati è troppo piccolo.
Si pubblicano più spesso i risultati positivi di quelli negativi: questo può succeder perché chi fa ricerca non ha interesse a pubblicare dati negativi, le riviste scientifiche danno più peso agli studi positivi, il ricercatore non è indipendente da chi finanzia lo studio, e non vuole rendere pubblici risultati negativi.
Si misura quello che è importante per i medici ma non per gli ammalati, per esempio: misure di laboratorio (per es. misure fatte sugli esami radiologici) problemi clinici lievi, misure di esito sulla base di scale mediche non rilevanti per i pazienti (per es. l’utilizzo di una scala medica che non corrisponde alle reali attività della vita quotidiana del paziente).
E’ difficile stabilirlo, perché le conoscenze in medicina evolvono rapidamente, ma si può dire di avere una risposta sufficientemente certa quando almeno alcuni studi ben fatti ottengono un risultato analogo.
Un singolo studio non basta! Così come non basta il parere dell’esperto, anche se si tratta di un medico famoso e autorevole.
Uno strumento disponibile per arginare l’incertezza, e arrivare a risposte più certe possibili sono le revisioni sistematiche.
Cosa è una revisione sistematica
E’ una valutazione di tutti gli studi disponibili su un determinato argomento. Il termine sistematica si riferisce al fatto che la revisione deve essere pianificata come un vero e proprio studio. Gli autori devono esplicitare dall’inizio – nel protocollo della revisione:
- gli obiettivi della revisione
- la metodologia seguita per rintracciare gli studi, indicando quali banche dati verranno interrogate (Medline, Embase, Cochrane library, archivio degli studi controllati randomizzati – banche dati che raccolgono gli studi pubblicati su riviste scientifiche)
- quali criteri seguono per decidere quale tipo di studi considerare (criteri di inclusione e di esclusione degli studi)
- quali esiti (outcome) considerano nella revisione
- come valutano la qualità degli studi
- quali metodi usano per combinare i risultati degli studi inclusi nella revisione
Con revisione sistematica si possono intendere diversi tipi di analisi degli studi condotti su un determinato argomento, ma in genere il termine indica un'analisi descrittiva della qualità metodologica e della rilevanza clinica degli studi.
Quando, nel contesto di una revisione sistematica, si procede anche a una sintesi quantitativa dei risultati dei singoli studi si parla di "metanalisi". La metanalisi è una tecnica statistica che permette di ottenere stime quantitative dei benefici e degli effetti avversi del trattamento di interesse, combinando i risultati degli studi simili tra loro, inclusi nella revisione.
I passaggi chiave della realizzazione di una revisione sistematica e di una metanalisi sono:
- formulazione del quesito;
- ricerca di tutte le informazioni rilevanti;
- analisi della loro qualità;
- sintesi quantitativa o qualitativa delle informazioni, a seconda della natura e complessità del quesito e della disponibilità dei dati;
- discussione delle ragioni di concordanza e discordanza tra i risultati dei diversi studi.
Le tre possibili fasi del processo di revisione sono:
- una revisione sistematica su tutti gli studi pubblicati;
- una metanalisi basata sui dati aggregati ottenuti dagli studi pubblicati;
- una metanalisi basata sui dati dei pazienti individuali ottenuti direttamente dai ricercatori che avevano condotto i singoli studi.
Vantaggi
Aumentano la forza delle conoscenze sull’associazione tra un intervento e i suoi effetti.
Permettono di valutare quanto sono riproducibili i risultati tra gli studi condotti su un argomento.
Permettono di valutare la concordanza dei risultati tra studi simili, condotti da ricercatori diversi.
Svantaggi
Non eliminano eventuali errori o inappropriatezze dei singoli studi inclusi nella revisione, che possono essere: inclusione di pazienti molto selezionati, vengono misurati esiti non davvero importanti per i pazienti, i trattamenti usati come controllo vengono scelti in modo opportunistico (per es. farmaco di controllo a dose più bassa se voglio dimostrare l’efficacia), influenza di conflitti di interesse.
Un altro limite importante è la pubblicazione selettiva degli studi (pubblication bias): gli studi con risultati positivi vengono pubblicati più spesso degli studi con risultati negativi, influenzando la valutazione delle conoscenze prodotte dagli studi su un certo argomento.
Un recente sistema di valutazione chiamato GRADE The Grading of Recommendations Assessment, Development and Evaluation [La graduazione della qualità delle prove e della forza delle raccomandazioni] vieneutilizzato per valutare criticamente la qualità delle prove disponibili su un determinato argomento, secondo 4 gradi: qualità alta, moderata, bassa, molto bassa. Questo sistema serve per guidare la produzione di raccomandazioni o linee guida più o meno forti, a seconda del grado di certezza dei risultati raggiunti dagli studi. I gradi di qualità del sistema GRADE sono:
Qualità alta: è molto improbabile che studi futuri possano cambiare la certezza dell’effetto riportato
Moderata: altri studi sono necessari per confermare la certezza dell’effetto
Bassa: è molto probabile che altri studi modifichino la certezza dell’effetto
Molto bassa: siamo molto incerti sull’effetto.
Riduzione assoluta del rischio, riduzione relativa del rischio, numero di persone da trattare…Cosa dicono queste misure ? Perché sono diverse?
I risultati di uno studio sull’efficacia di un trattamento nel prevenire un evento indesiderato (per es. la progressione di disabilità) rispetto a un trattamento di controllo (o al placebo) possono essere espressi in termini di probabilità dei pazienti trattati con il farmaco in studio e quelli non trattati di andare incontro all’evento (rischio assoluto). Dalle percentuali di soggetti colpiti dall’evento prima del termine dello studio in ciascuno dei due gruppi si possono ricavare due tipi di informazioni:
- la riduzione assoluta del rischio : ci dice di quanto diminuisce in assoluto il numero di persone che ha un evento negativo assumendo il farmaco in studio rispetto al numero di persone che ha un evento negativo senza assumere il farmaco
- la riduzione relativa del rischio: ci dice di quanto diminuisce in percentuale il rischio di avere un evento negativo nelle persone che assumono il farmaco rispetto alle persone che non lo assumono.
La scelta dell’una o dell’altra misura per esprimere il beneficio di un trattamento può portare a conclusioni molto diverse.
Nel nostro esempio, dopo 2 anni le persone con sclerosi multipla che avevano avuto una progressione di disabilità erano 20 su cento nel gruppo trattato con interferone e 29 su cento in quello di controllo. I due dati possono essere confrontati in due modi diversi.
- Si può dire che il numero di persone che ha avuto una progressione di disabilità è diminuito in assoluto del 9 per cento (29 meno 20), ossia 9 persone in meno su cento hanno avuto progressione con l’interferone (riduzione assoluta del rischio).
E’ la differenza tra il rischio di chi prende l’interferone e il rischio di chi non lo prende.
- Oppure si può dire che c’è stato un calo del rischio del 9 per cento rispetto al rischio del 29 per cento di chi non prende l’interferone, vale a dire una riduzione percentuale del 31 per cento (9 diviso 29= 0,31) (riduzione relativa del rischio).
E’ il rapporto tra il calo di rischio dato dal prendere l’interferone e il rischio che si ha senza prendere l’interferone. Non dice quanto sia grande il rischio in termini assoluti: se prendendo un farmaco si ha una riduzione relativa del rischio del 31%, per sapere la portata di questa riduzione è necessario sapere quante persone hanno l’evento negativo alle condizioni di partenza, senza assumere il farmaco, cioè quanto la progressione di disabilità è diffusa tra le persone con sclerosi multipla che non assumono l’interferone.
Si può dire che prendendo l’interferone si ha una riduzione assoluta del rischio di progressione del 9% (trattati meno non trattati) e una riduzione relativa del rischio del 31% (rispetto a chi non assume l’interferone).
Il beneficio del trattamento appare molto più grande se si utilizza la riduzione relativa rispetto alla riduzione assoluta del rischio. In particolare quando in uno studio clinico la frequenza degli eventi è bassa, presentare i risultati in termini di riduzione relativa piuttosto che in termini di riduzione assoluta può portare a ritenere il farmaco più vantaggioso.
Modi diversi di rappresentare l’efficacia di un farmaco possono portare a decisioni diverse: la propensione a prescrivere dei medici cresce molto se i risultati sono presentati sotto forma di riduzione relativa del rischio anziché sotto forma di NNT o di riduzione assoluta del rischio.
Un altro modo di esprimere i benefici di un farmaco è il "numero di persone che è necessario trattare" (NNT). Supponiamo di dover decidere se iniziare la terapia con interferone. Disponiamo di due studi: il primo realizzato con persone con sclerosi multipla che per le loro caratteristiche cliniche avevano un alto rischio di progressione della disabilità, e il secondo con persone con un rischio basso. In entrambi gli studi l'efficacia relativa dell’interferone risulta del 31 per cento, intesa come riduzione percentuale del rischio di progressione in chi assume l’interferone rispetto a chi non lo assume.
Nel nostro esempio, nel primo studio 60 persone su cento non trattate hanno avuto progressione della disabilità a due anni, nel secondo studio solo 10 su cento. Grazie all’interferone, c’è stato un calo del rischio di progressione del 41 per cento nel primo studio ma solo del 7 per cento nel secondo studio, con una riduzione assoluta pari a 19 persone in meno su cento (cioè 60-41) con progressione nel primo studio e a 3 persone in meno su cento (10-7) nel secondo studio.
II "numero che è necessario trattare" (NNT) è il reciproco della riduzione assoluta, cioè 1/19 su cento (=5) nello studio con persone a rischio elevato e 1/3 su cento (=33) con persone a rischio basso. Su 5 persone ad alto rischio che assumono l’interferone una trarrà beneficio dalla terapia, mentre su 33 persone a basso rischio solo una ne beneficerà.
L’NNT può essere usato per prendere decisioni se iniziare una terapia, anche se questa decisione non è solamente di natura quantitativa, non è sufficiente cioè fare riferimento solo a un numero come l’NNT. La decisione dipenderà anche dal bilanciamento tra rischi e benefici del trattamento e dai valori posseduti dal medico e dalla persona.
Voci ricavate con modifiche da Morosini P, Perraro F. (2001). Enciclopedia della Gestione di Qualità in Sanità. II Ed. Torino, Centro Scientifico Editore e da glossario del sito e dispensa "Orientarsi in salute e sanità per fare scelte consapevoli" del progetto PartecipaSalute.
Responsabile della pubblicazione: Redazione Progetto IN-DEEP
Ultimo aggiornamento: 16/05/2019



